P(v) = 4 π (M / 2 π RT)3/2 v2 e-Mv**2/(2RT)
其中 P(v) 代表速率為 v 之粒子的機率分佈,積分所有速率值會得到 1。
函數的樣子見圖 ( T = 300K )
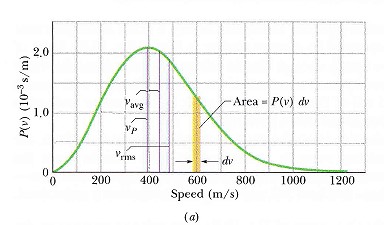
平均速率、均方根速率、最可能速率
雨水 (水蒸氣) 與陽光 (質子核融合) 的來源
氣體動力論
溫度的微觀意義
EK = 3/2 k T
壓力
(微觀)氣體分子運動與(巨觀)壓力的關係
L 為邊長立方容積內,分子對一個面所造成撞擊的動量改變是
Δpx = (-m vx) - (m vx) = - 2 m vx
因此分子對容器壁所造成的力,每次撞擊是 2 m vx
然而,每單位的間內有多少次撞擊呢?
容器長是 L,以 vx 的飛行速度,假設 Δt 是每碰一次同一面的器壁所需的時間(碰到另一面的不算),則此 Δt 是 2L / vx
也就是說,每 Δt 的時間內,有 2 m vx 的動量改變
利用 F = m a = m dv /dt = d (mv) /dt = dp / dt
F = dp / dt = Δpx / Δt = 2 m vx / (2L / vx) = m vx2 / L
其他所有分子都算進去
p = Fx / L2 = (1/L2) Σ i=1N Fxi = (1/L3) m Σi=1N vxi2 = (m/ L3) <vx2>avg
<vx2>avg = Σi=1N vxi2
對任何分子,v2 = vx2 + vy2 + vz2
故 <vx2>avg = (1/3) <v2>avg
定義 vrms ≡ √<v2>avg 叫做均方根速率 (root-mean-squire velocity)
總分子數是 N = n NA (其中 NA 是亞佛加厥常數)
p = (mn NA / 3V ) vrms2 = n (m NA) vrms2 / 3V = n M vrms2 / 3V
因此,建立了壓力與均方根速率之間的關係
p = n M vrms2 / 3V
如果把理想氣體方程式當作己知,代入 p V = n R T ,則得 vrms = √(3 R T / M)
反之,若是套用能量均分原理的結果,則 "理想氣體方程式" 是可以被導出來的,見下。
習題:推導 氣體分子運動與 壓力的關係
能量均分原理
每一個自由度分到 (1/2) k T 的平均動能。也就是說在平衡下,每個分子有 (3/2) kT的動能。
前有 p = (mn NA / 3V ) vrms2 ,故 pV = (1/3) n NA 2 (1/2 m vrms2) = (2/3) n NA [3/2 kT] = n (NAk) T = n R T
也就是說,套用 能量均分原理 就可以導出 理想氣體方程式
從另一個角度來看,p V = n R T 全是由巨觀量所組成,是可透過實驗來驗證的。
體積(氣體有別於液體的特性)
充滿容器
理想氣體方程式
p V = n R T
推導出平均移動動能
Kavg = (1/2 m v2)avg = 1/2 m (v2)avg = 1/2 m vrms2
= 1/2 m (3 R T / M) = 3RT/2NA = 3/2 (R/NA) T = 3/2 k T
平均自由路徑
氣體中每個分子都不斷的碰撞而改變方向,擴散相關性質與一個分子平均直走多遠是後才被撞到有關。
與密度 N/V 有關,N/V 越大 λ 越小;另外,分子截面積越大, λ 也越小。
λ= 1/ ( √2 π d2 N/V )
作業:上式的證明(詳見課本)
Maxwell 速率分佈
P(v) = 4 π (M / 2 π RT)3/2 v2 e-Mv**2/(2RT)
其中 P(v) 代表速率為 v 之粒子的機率分佈,積分所有速率值會得到 1。
函數的樣子見圖 ( T = 300K )
平均速率、均方根速率、最可能速率
雨水 (水蒸氣) 與陽光 (質子核融合) 的來源
理想氣體的比熱
莫耳比熱
內能即動能
分子間沒有交互作用位勢的關係
動能平均是知道的,為 (3/2) kT
Eint = (n NA) (3/2 kT) = 3/2 n R T (單原子)
定容莫耳比熱
無作功
Cv = 3/2 R
定壓莫耳比熱
Cp = Cv + R
轉動與振動的額外自由度
利用 Maxwell 提出的 能量均分原理
量子效應
在某高溫以上才開始有轉動,再更高才有振動,可由比熱隨著溫度的變化而得知。
如圖
理想氣體的絕熱膨脹
絕熱膨脹
自由膨脹
觀察:氣體分子動力學模擬
真實(非理想)氣體的額外考量
電腦模擬的學理基礎:系綜平均與時之平均
時間的方向問題 (http://en.wikipedia.org/wiki/Entropy_%28arrow_of_time%29)