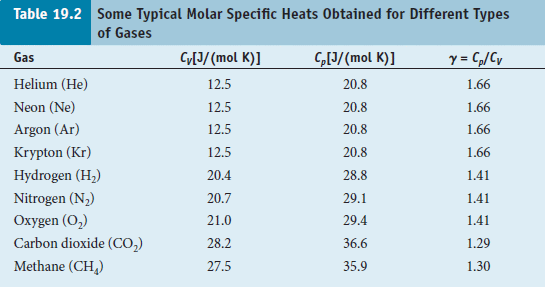
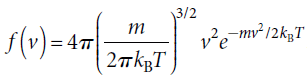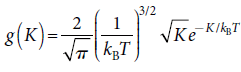單原子氣體
Eint = N Kavg = N 3/2 kB T
定容比熱
如何得定容比熱?
依定義 Q = n CV ΔT
ΔEint = Q - W = Q -p dV = Q - 0 = Q = n CV ΔT
由上式 ΔEint = 3/2 N kB ΔT = 3/2 n R ΔT
故 CV = (3/2) R
對理想氣體
Eint = n CV T
意指 理想氣體 內能只與 n、CV、T 有關
定壓比熱
如何得定壓比熱?
再次依定義 Q = n Cp ΔT (定壓下)
由熱力學第一定律 ΔEint = Q - W = Q - p ΔV
將上上式 Q = n Cp ΔT 代入並套用前已制定之理想氣體 Eint = n CV T
ΔEint = Q - p ΔV = > n CV T = n Cp ΔT - p ΔV
使用 理想氣體 方程式 p ΔV = nR ΔT (定壓下)
n CV T = n Cp ΔT - n R ΔT
可得
CV = Cp - R
即
Cp = CV + R
定壓定容比熱之比率
γ ≡ Cp / CV
自由度
根據能量均分原理,每一個自由度有 1/2 kB T 的能量
故
Eint = 3 Df n RT / 2
CV = 3 Df RT / 2
Cp 則一樣是 Cp = CV + R
故比率:
5/3 , 7/5, 9/7 ...
與實驗不同的情況,來自量子效應的差異,要有足夠能量,才能激發該轉動與振動的自由度(振動的能量門檻尤其要高一些)。
課本的討論法,是只考慮移動與轉動,而把振動當作額外的考量。此一作法,與把能量均分不看作是原理的作法是相互應的,也就是說,只在理想氣體的層級下建立能量均分(事實上,課文中也使用了原理這樣約名稱來賦予每個多出來的自由度 1/2 kB T 的平均能量)
因此,課本對多原子分子氣體的討論方法如下:
有完整的三個方向的運動,以及三個軸的轉動,共六個 "自由度",因此,CV = 6/2 R = 3 R,γ = 4/3